![]()
© 1998 Институт химии растворов РАН
Получено 10.01.97 г.
Изучена возможность извлечения ионов тяжелых металлов из низкоконцентрированных металлсодержащих растворов в виде малорастворимых внутрикомплексных соединений с оксихинолином. Определены оптимальные условия осаждения. Предложена и на реальных объектах испытана схема последовательной реагентной очистки стоков красильно-отделочного производства. Показано преимущество применения оксина по сравнению с традиционно существующими способами при удалении ионов тяжелых металлов из сточных вод текстильных предприятий до уровня ПДК.
Проблема очистки сточных вод в текстильной промышленности стоит достаточно остро. Значительное число предприятий отрасли или совсем не имеет очистных сооружений, или имеющиеся системы не обеспечивают очистку СВ до уровня существующих требований. В сложившейся ситуации наиболее целесообразным считают организацию системы оборотного водопользования и систему локальной очистки с выделением из общего числа стоков наиболее вредных по составу, например, содержащих тяжелые металлы [1].
В текстильной промышленности наиболее загрязненными в токсикологическом отношении являются сточные воды красильно-отделочного производства. Многие красители содержат в своем составе металлы, а в технологии крашения или отделки используются металлсодержащие химические реактивы. В результате в сточных водах обнаруживаются тяжелые металлы, например, хром, медь, железо, в количествах, намного превышающих допустимые нормы [2].
Таким образом, существующие в настоящее время на текстильных предприятиях системы очистки сточных вод от тяжелых металлов не позволяют достичь значений предельно допустимых концентраций, а предлагаемые методы глубокой очистки требуют больших материальных затрат, соизмеримых со стоимостью самого производства. Поэтому задача создания доступного и эффективного способа удаления ТМ из СВ текстильных предприятий является актуальной.
Содержание ионов металлов в сточных водах текстильных предприятий, в отличие от предприятий металлообрабатывающей, химической промышленности и ряда других производств, относительно невелико - от единиц до десятых и сотых долей мг на литр. Удаление ионов из их разбавленных растворов представляет наибольшую трудность. Достаточно эффективным приемом в этом случае является перевод металла из растворенной в осажденную форму с произведением растворимости, не превышающим 1.10-8 [3]. На практике ТМ обычно удаляют осаждением в виде гидроксидов, ПР которых значительно меньше указанной величины. Однако образующийся осадок имеет рыхлую структуру, повышенную растворимость за счет высокого солевого фона сточных вод. В случае низкоконцентрированных растворов металлов образуется слабый коллоидный раствор, требующий дальнейшей операции - коагулирования.
Известен целый ряд органических соединений,
которые образуют с ионами металлов
малорастворимые комплексные соединения. В
настоящей работе изучается возможность
использования 8-оксихинолина (оксина) для
реагентного выведения ионов тяжелых металлов из
сточных вод текстильных предприятий. Действие
этого соединения определяется наличием в его
молекуле функциональной группировки
гетероциклического азота ![]() N- с основными
свойствами в сочетании с фенольной R-OH группой,
обусловливающей кислотные свойства реагента. В
результате в растворе оксихинолин
взаимодействует с ионами многих металлов в
широкой области концентраций ионов водорода,
образуя устойчивые, малорастворимые хелатные
соединения [4]:
N- с основными
свойствами в сочетании с фенольной R-OH группой,
обусловливающей кислотные свойства реагента. В
результате в растворе оксихинолин
взаимодействует с ионами многих металлов в
широкой области концентраций ионов водорода,
образуя устойчивые, малорастворимые хелатные
соединения [4]:
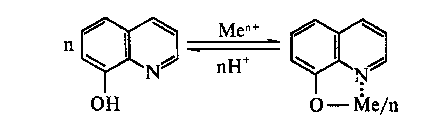
Важнейшая особенность 8-оксихинолина состоит в том, что он взаимодействует с ионами элементов при тех же значениях рН, при которых эти ионы начинают гидролизоваться, а произведения растворимости образующихся комплексов, особенно двухвалентных металлов, на несколько порядков ниже, чем значения ПР соответствующих гидроксидов. Предлагаемый препарат не селективен, и его избыток может быть удален с осадком других металлов, например, железа или алюминия, которые вводятся в СВ в качестве коагулянтов.
Для выявления возможности и условий осаждения
ионов металлов из их разбавленных растворов с
помощью оксихинолина проводили предварительные
исследования на имитаторах металлсодержащих
сточных вод, в качестве которых использовали
растворы ионов металлов - сульфата меди (II)
концентрации 7,8.10-6 моль/л.
Осадитель-комплексообразователь готовили в виде
раствора концентрации 7.10-3 моль/л в
уксусной кислоте при рН 3,5, гидроксида натрия -
при рН 13 и в этиловом спирте. Определенный объем 50
мл исходного раствора металла смешивали с
необходимым количеством раствора лиганда и
доводили до заданного значения рН раствором NaOH
концентрации 0,1 моль/л. Полученный раствор
выдерживали при комнатной температуре для
вызревания осадка в течение нескольких часов.
Реакции образования оксихиналинатов металлов
протекают быстро и необратимо. Для визуального
наблюдения осадка использовали стадию
созревания, т.к. общее количество ионов меди в
каждом опыте не превышало 0,025 мг. В зависимости от
условий осаждения наблюдали светло-зеленые
кристаллы образовавшихся комплексов. Количество
оставшихся в растворе ионов металла определяли
экстракционно-фотометрическим методом с
диэтилдитиокарбаматом свинца в CCl4 [5]. Взаимодействие ионов
меди с оксихинолином проводили при различных
значениях концентрации водородных ионов и
соотношениях металл : лиганд, равных 1:3, 1:6, 1:9.
Экспериментальные данные приведены в таблице ![]() .
.
Осадитель-комплексообразователь 8-оксихинолин
малорастворим в воде, поэтому исследовали его
растворимые формы в кислоте, щелочи и спирте.
Установлено, что наиболее устойчивой формой
осадителя являются его кислые, в данном случае
ацетатные, растворы. Приготовленный специальным
методом, он может храниться почти неограниченно
долго. Спиртовый и щелочной растворы оксина,
менее устойчивые во времени, лучше использовать
свежеприготовленными и хранить на холоде при
защите от света. На рис. 1 ![]() представлены
зависимости степени извлечения ионов меди из
раствора различными растворенными формами
осадителя при различных значениях рН осаждения.
Степень извлечения
представлены
зависимости степени извлечения ионов меди из
раствора различными растворенными формами
осадителя при различных значениях рН осаждения.
Степень извлечения ![]() рассчитывали по
формуле:
рассчитывали по
формуле:
![]() =(co-ci)/co .100%
=(co-ci)/co .100%
где co и ci- концентрации ионов меди в
растворе до и после осаждения, соответственно.
Видно, что для щелочной формы оксина область максимального извлечения ионов меди (90-92 %) наблюдается в широком интервале концентраций ионов водорода, рН 5-11. Для кислой и спиртовой форм максимальная степень удаления ниже, не более 80-86 %, и достигается в более узком диапазоне рН - 7,5-9,5.
Оксихинолин, как слабое основание, в кислой среде значительно протонируется и находится, главным образом, в виде катиона H2R+. В результате многие металлы уже в кислой среде реагируют с лигандом, замещая атом водорода в фенольном гидроксиле и образуя координационную связь с азотом. При этом выделяются два протона, раствор несколько закисляется. Снижение рН для кислой формы оксихинолина особенно характерно при осаждении в нейтральной и слабощелочной среде (табл.). В щелочных растворах лиганд находится в виде аниона R-, и образование комплекса происходит без заметного изменения кислотности среды. В результате комплекс Cu2+ c оксином в щелочной форме устойчив в более широкой области концентраций ионов водорода, чем комплекс Cu2+ с оксином в кислой форме (рис. 1).
Для оценки растворимости оксихинолятов меди раствор реагентов после смешения выдерживали в течение нескольких часов и контролировали образование осадка. Было замечено, что комплексы, полученные лигандом в форме катиона, в области максимального выхода в зависимости от времени вызревания образуют ярковыраженный осадок - светло-зеленые хлопья, иглы или пучки. Для спиртовой формы при осаждении Cu2+ наблюдали хлопьевидный осадок, который со временем растворялся. При взаимодействии Cu2+ с оксином в анионной форме раствор оставался практически прозрачным при выстаивании до 72 часов и девятикратном избытке лиганда. Следует отметить, что в отсутствии комплексообразователя при добавлении щелочи к раствору меди вплоть до рН 12 осадок гидроксида металла не образовался. Следовательно, наибольшей растворимостью при одинаковых условиях обладают медные комплексы щелочной формы оксина, наименьшей - кислой. Различные значения максимальной степени извлечения ионов меди растворами оксихинолина в кислой, щелочной и спиртовой формах (рис. 1), по-видимому, можно объяснить различными значениями констант устойчивости образующихся комплексов К и произведений растворимости ПР их осадков.
Зависимость степени извлечения ионов меди
оксихинолином в щелочной форме от количества
лиганда и времени вызревания в условиях
оптимального осаждения рН 11 представлена на рис. 2 ![]() . Видно, что при минимальном избытке
лиганда, необходимом для количественного
осаждения меди - соотношение металл : лиганд 1:3 (50
%-ный избыток против стехиометрии) - можно достичь
максимальной степени извлечения 90-95 %, увеличивая
время вызревания осадка до 48 часов. Однако это не
всегда приемлемо, особенно в условиях
производства. Используя избыток
комплексообразователя, можно значительно
уменьшить время осаждения. При 6-ти и более
кратном избытке лиганда время вызревания
практически не влияет на полноту удаления ионов
меди (рис. 2a).
. Видно, что при минимальном избытке
лиганда, необходимом для количественного
осаждения меди - соотношение металл : лиганд 1:3 (50
%-ный избыток против стехиометрии) - можно достичь
максимальной степени извлечения 90-95 %, увеличивая
время вызревания осадка до 48 часов. Однако это не
всегда приемлемо, особенно в условиях
производства. Используя избыток
комплексообразователя, можно значительно
уменьшить время осаждения. При 6-ти и более
кратном избытке лиганда время вызревания
практически не влияет на полноту удаления ионов
меди (рис. 2a).
В результате на примере разбавленных растворов меди было установлено, что 8-оксихинолин является эффективным реагентом для удаления ионов металлов из низкоконцентрированных металлсодержащих растворов. Осаждение следует проводить в нейтральных и слабощелочных средах в 6-9-кратном избытке комплексообразователя. В качестве последнего нужно использовать растворы оксина в кислоте рН 3-3,5 или спирте. Степень извлечения составляет 90-95 %.
На основании полученных данных предложена и в лабораторных условиях опробована схема последовательной реагентной очистки объединенных стоков процессов крашения, отделки и промывки ткани текстильного производства. Испытания показали преимущество применения органического осадителя для удаления тяжелых металлов из сточных вод по сравнению с традиционно существующими способами - концентрации трех из четырех контролируемых элементов Cu, Fe, Zn и Cd оказались ниже предельно допустимых значений.
![]()